北京基因组所(国家生物信息中心)合作发现线粒体能量代谢紊乱参与先天性纯红细胞再生障碍性贫血的发病机制
红细胞生成是一个复杂、动态、受严格调控的生物学过程,该过程可产生人体所有的成熟红细胞。红细胞来源于造血干祖细胞(HSPCs),并依次经历爆式红系集落形成单位(BFU-E)、红系集落形成单位(CFU-E)、成红细胞前体(pro-E)、嗜碱性成红细胞(Baso-E)、多染性成红细胞(Poly-E)、正染性成红细胞(ortho-E)等阶段逐渐分化成熟,脱核后成为网织红细胞(reticulocyte)。能量代谢在红细胞生成的不同分化阶段发挥重要调控作用,但当前我们对于能量代谢调控红细胞生成的机制仍然知之甚少。同时,能量代谢紊乱是否与红系造血相关疾病的病理机制存在关联,能否从能量代谢的角度为红系造血相关疾病的治疗提供潜在干预靶点等一系列科学问题亟待解答。
线粒体氧化磷酸化(OXPHOS)可通过线粒体电子传递链产生人体细胞生物过程所需的大部分能量,OXPHOS通路缺陷可导致人类多种疾病,据估约1:5 000的疾病发病与OXPHOS缺陷有关。这些疾病主要集中发生在心脏和肌肉等需要大量能量的组织或器官中。OXPHOS与红系造血相关疾病之间的研究一直鲜有报道。核糖体生物合成也是一个能量依赖的生物学过程,核糖体水平是驱动红细胞分化和决定红系祖细胞命运的主要决定因素。核糖体生物合成受损与多种红系造血缺陷的遗传疾病有关,其中包括先天性纯红细胞再生障碍性贫血(Diamond-Blackfan Anemia, DBA),因此能量代谢是否与DBA病理机制存在关联,是研究团队一直关注的科学问题。
近日,中国科学院北京基因组研究所(国家生物信息中心)方向东研究组与中国医学科学院血液学研究所竺晓凡研究组合作在iScience 在线发表了题为“Disruption of mitochondrial energy metabolism is a putative pathogenesis of Diamond-Blackfan Anemia”的研究论文。该研究首次探讨了OXPHOS缺陷对红细胞生成的影响及分子机制,以及能量代谢紊乱与DBA病理机制之间的关联。
通过分析骨髓单细胞转录组数据,研究人员发现线粒体OXPHOS功能在CFU-E向Pro-E的红系分化过程中开始特异性显著富集,提示OXPHOS可能在红系分化早期发挥重要调控作用。通过构建OXPHOS 抑制的造血干祖细胞红系分化细胞模型,发现OXPHOS抑制可导致红系祖细胞分化出现特异性缺陷,使伴随的核糖体生物合成受损,以及细胞凋亡增加等,这些表型均模拟了DBA病理特征。
机制上,研究人员鉴定了RanGAP1是OXPHOS抑制后导致红细胞生成过程中核糖体生物合成缺陷的分子靶标,过表达RanGAP1可以很大程度上挽救抑制OXPHOS导致的红系造血缺陷。通过在体系中添加CoQ10(OXPHOS激活剂)可以部分挽救红系造血缺陷并显著提升了RanGAP1蛋白表达。为进一步研究OXPHOS与DBA病理机制的关联,研究人员对10例DBA患者骨髓进行了批量RNA-Seq分析,发现OXPHOS和核糖体生物合成通路均被显著抑制,且有约10% OXPHOS基因发生移码突变和终止密码子突变等,推测这些突变可能是导致DBA患者OXPHOS通路被抑制的原因。
综上,本研究揭示了线粒体氧化磷酸化通路在红细胞生成中的作用及其分子机制,发现能量代谢紊乱可能参与了DBA发病机制。该研究为探索DBA潜在治疗靶点提供了新思路。
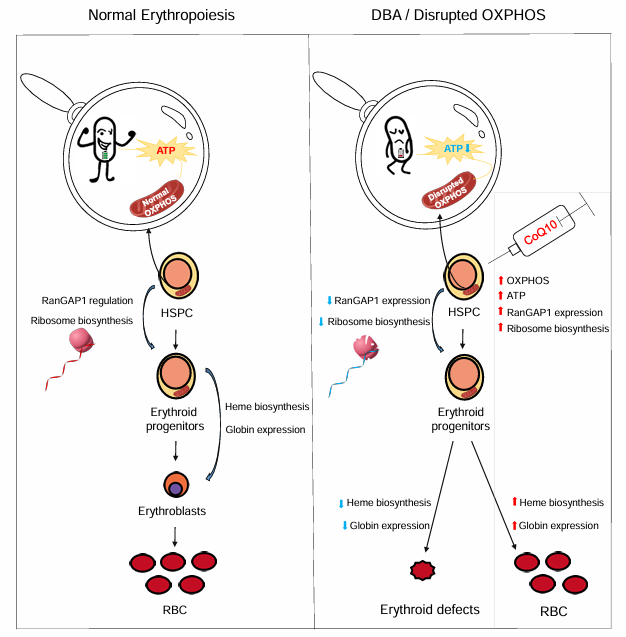
线粒体能量代谢参与红细胞分化发育机制
中国科学院北京基因组研究所(国家生物信息中心)方向东研究员、中国医学科学院血液学研究所竺晓凡研究员和中国科学院北京基因组研究所(国家生物信息中心)张昭军副研究员为文章的共同通讯作者。中国科学院北京基因组研究所(国家生物信息中心)研究生肖茹丹、张立娟、辛子娟为文章的并列第一作者。该研究得到中科院战略性先导科技专项和国家自然科学基金等项目的资助。






