基因组所REV1和FANCD2协同保护新生DNA链应答复制压力机制研究获新进展
REV1是真核生物一种特殊的DNA聚合酶,其可以作为一个有效靶标用于肿瘤治疗,降低REV1水平不仅能增强肿瘤细胞对化疗的敏感性,还能有效降低肿瘤细胞耐药性的产生。前期研究显示REV1能参与跨损伤DNA合成并引发基因组突变。最近一些研究发现,在出芽酵母、鸡DT40细胞、黑腹果蝇细胞及人类细胞中REV1参与DNA双链断裂的同源重组(HR)。然而关于REV1是如何被招募到HR位点及其确切功能还很不清楚。
近日,中国科学院北京基因组研究所精准基因组医学重点实验室郭彩霞研究组和动物研究所生物膜国家重点实验室唐铁山研究组合作发现,在复制压力存在下,REV1和FANCD2能协同作用保护新复制的DNA链免受核酸酶的降解,该研究成果在Nucleic Acids Research在线发表。
本研究首先回转REV1到敲低细胞证实了REV1确实直接参与HR,进而通过特异设计的报告系统发现了REV1参与复制依赖的HR;利用激光显微辐射系统在细胞核内定点诱发DNA双链断裂(DSBs),发现REV1可以被招募到DSBs,这种招募依赖于REV1泛素结合结构域、RAD18及单泛素化的FANCD2;在RAD18敲低的稳定细胞系中表达FANCD2-Ub嵌合体蛋白会增加REV1在DSBs的招募,揭示单泛素化的FANCD2作为RAD18的下游蛋白负责招募REV1到损伤位点;此外,REV1在激光造成的DNA损伤位点处的招募还受BRCA1和BRCA2调控;特别地,利用IdU和CIdU标记新合成的DNA链,通过DNA fiber实验发现在羟基脲或喜树碱处理后,REV1能保护新生DNA链不被核酸酶降解,维持受阻复制叉的稳定。
该研究成果表明REV1在DNA损伤应答中发挥多种重要功能,完善了其作为肿瘤治疗靶标的理论基础。
本工作受到中国科学院、科技部和国家自然科学基金委的资助,得到了北京蛋白质中心裴华东研究员、西南医学中心放射肿瘤系Benjamin Chen和荷兰莱顿大学Niles de Wind课题组等的大力支持。
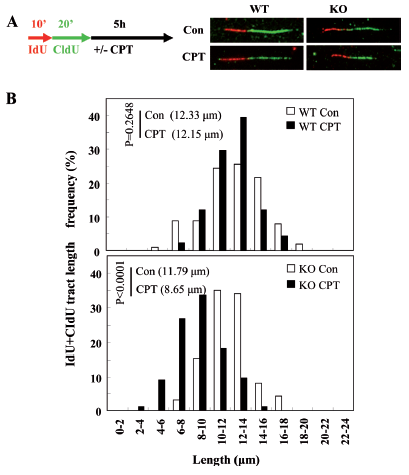
REV1保护新生DNA链免受核酸酶降解






