北京基因组所(国家生物信息中心)合作揭示m6A去甲基化酶FTO调控肿瘤免疫逃逸新机制
CD8+ T细胞是机体识别与杀伤肿瘤细胞的关键免疫细胞,其功能却常常被复杂的肿瘤微环境所抑制。前期研究表明,肿瘤细胞可利用多种表观修饰机制调节T细胞介导的抗肿瘤免疫应答,从而实现免疫逃逸。而m6A作为一种动态可逆的表观转录组修饰,影响mRNA的稳定性及翻译等过程,在肿瘤的发生发展中起到重要的作用。然而,肿瘤细胞的m6A修饰如何参与调节肿瘤免疫微环境,调控T细胞介导的免疫监视,目前仍不太清楚。
4月27日,中国科学院北京基因组研究所(国家生物信息中心)韩大力研究组联合清华大学免疫研究所徐萌团队、中科院上海药物研究所杨财广团队,在Cell Metabolism 杂志在线发表题为“Tumors exploit FTO-mediated regulation of glycolytic metabolism to evade immune surveillance”的研究论文,揭示了m6A去甲基化酶FTO通过表观转录组调控,增强肿瘤细胞糖酵解代谢,进而抑制T细胞激活和抗肿瘤功能的免疫逃逸新机制。
研究人员发现,在不同实体瘤细胞中敲低m6A的去甲基化酶FTO,均能抑制肿瘤在小鼠体内的生长,并增加肿瘤中浸润的抗原特异性CD8+ T细胞的比例。进一步的研究表明,在肿瘤中敲低FTO会使CD8+ T细胞更快地激活,更有效地执行杀伤肿瘤细胞的功能。通过对RNA-seq、MeRIP-seq (m6A-seq)、ATAC-seq、ChIP-seq等多维组学测序数据的整合分析发现,FTO可调控多个bZIP家族转录因子的m6A修饰,并促进其mRNA稳定性。这些bZIP家族转录因子能促进糖酵解基因的表达,增强肿瘤细胞糖酵解活性,进而抑制CD8+ T细胞的激活。基于此,研究者以靶向FTO的小分子抑制剂Dac51为小分子工具,进一步验证FTO在实体瘤中通过调控肿瘤糖酵解,逃逸免疫监视的机制。随后,在小鼠模型中分别采用了PD-L1阻断和Dac51小分子的治疗,发现其均能有效抑制肿瘤在小鼠体内生长,而联合PD-L1和Dac51能大幅提升治疗效果。另外,研究者在病人肿瘤样本建立的类器官模型中也发现,Dac51处理能有效地增强T细胞的抗肿瘤免疫应答,提示了Dac51在临床应用上的可能性。综上,研究者提出,m6A去甲基化酶FTO可作为免疫治疗的有效靶点,对RNA修饰进行干预将有望成为免疫治疗的新策略。
中国科学院北京基因组研究所(国家生物信息中心)韩大力研究员,清华大学医学院徐萌研究员和中科院上海药物研究所杨财广研究员为论文的共同通讯作者。中国科学院北京基因组研究所(国家生物信息中心)硕士生梁广豪,清华大学博士生刘弋和董文鑫,中科院上海药物研究所博士生徐洪蛟和董泽博士为共同第一作者。该研究得到了国家重点研发计划、国自然生物大分子重大研究计划、中国科学院战略性先导科技专项等基金资助。
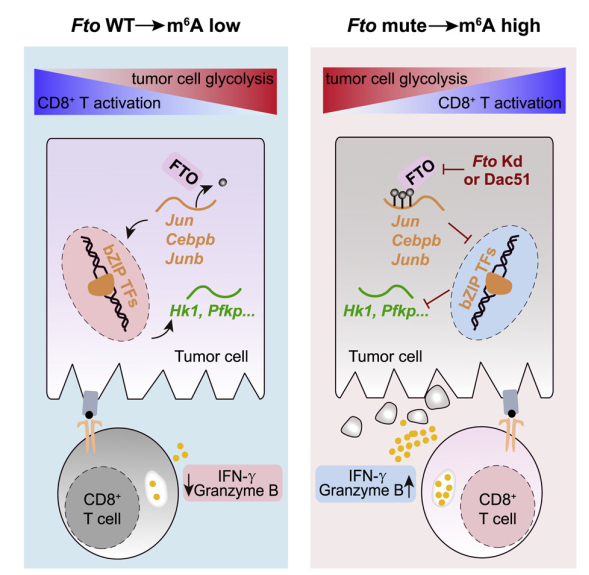
m6A修饰去甲基化酶FTO促进肿瘤糖酵解并限制T细胞免疫应答。使用FTO小分子抑制剂Dac51进行治疗可以增加肿瘤内CD8+ T细胞浸润并与PD-L1阻断治疗产生协同效应