基因组所肥胖调控机制合作研究获进展
近日,中国科学院北京基因组研究所杨运桂研究员与美国芝加哥大学何川教授,合作研究发现了肥胖相关基因FTO(Fat mass and obesity-associated protein)主要作用底物是RNA 中的6甲基腺嘌呤(m6A)。文章《N6-Methyladenosine in Nuclear RNA is the Main Substrate of the Obesity-Associated FTO Protein》于10月16日在线发表在自然子刊《Nature Chemical Biology》杂志上。该研究为揭示FTO调控肥胖发生机制提供了重要线索。基因组所杨运桂研究组博士研究生赵旭参与了本课题研究工作,并为本论文的共同第一作者。
目前,肥胖已成为世界五大流行性疾病之一,严重危害着人口健康。全球约有16亿成年人面临着超重,4亿人患有肥胖症。在中国成人超重和肥胖率分别是32.1%和9.9%。肥胖是2型糖尿病和心血管疾病发生的主要诱因之一,并且与骨性关节炎以某些癌症的发生紧密相关。治疗肥胖的关键是找到肥胖相关基因。全基因组关联研究已发现超过600个基因位点与肥胖发生相关。其中, FTO因其在大量不同人群中被证实与肥胖紧密相关,被定义为第一个肥胖基因。通过序列比对,研究人员发现FTO具有大肠杆菌AlkB加双氧酶家族的去甲基化酶活性的功能结构域。FTO基因敲除和过表达小鼠模型均表现出体重改变和脂肪组织异常等现象。但从FTO被发现至今,其作用机制尚未报道。
6甲基腺嘌呤(m6A)是mRNA中存在的主要甲基化形式,平均每一条mRNA含有3-5个,存在于保守序列RGACU(R=G、A、U)中。不同基因mRNA的m6A水平存在着差异。m6A可能与mRNA剪切、运输等加工过程相关。但mRNA中m6A的生物学功能还并不清楚。在拟南芥中研究发现,m6A甲基化酶MTA及其互作蛋白AtFIP37均定位于mRNA剪切因子“仓库”speckle。由此推测,m6A水平的改变可能影响相关基因可变剪切形式,从而引起特殊的表型特征。
本研究通过体外模拟生理环境下的去甲基化反应条件,将FTO的野生型和突变型蛋白分别与甲基化底物共同孵育,利用质谱和高效液相技术,对多种甲基化形式进行探索,最终发现FTO对单链RNA上的m6A具有去甲基化功能。同时,体内实验验证,在FTO基因敲低细胞中mRNA中的m6A水平升高;相反,在FTO过表达细胞中mRNA中的m6A水平降低;而m6A甲基化酶METTL3的表达均未受到影响。免疫荧光实验证实,FTO在细胞核中呈点状分布。通过与各种细胞核内亚细胞器标志分子共染,发现FTO与speckle 标志分子SC35、U4/U6.U5 snRNA相关蛋白SART1、转录酶RNA PolII(2位Ser磷酸化)有部分共定位。转录抑制后,类似RNA PolII(2位Ser磷酸化),FTO会聚集到speckle中。而m6A甲基化酶METTL3也定位于speckle。因此,FTO可能通过调控mRNA上m6A甲基化的逆转参与mRNA加工。
该研究工作的完成为FTO和其m6A甲基化mRNA底物相对应的基因可能成为肥胖诊断和治疗的候选靶标,以及肥胖相关基因FTO对m6A去甲基化功能的发现两方面具有重要科学意义。该论文的发表无疑为RNA甲基化修饰作为一种具有重要生物学调控功能的广义表观遗传新概念提供了重要证据。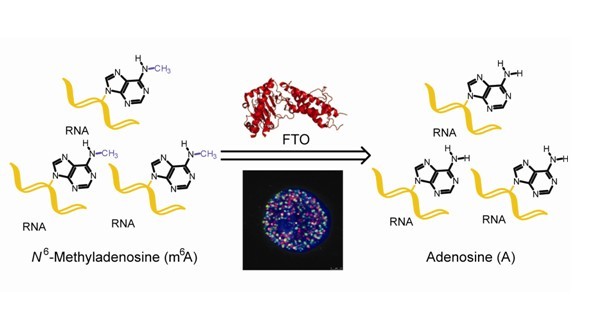
文章链接见:(http://www.nature.com/nchembio/journal/vaop/ncurrent/full/nchembio.687.html)
DOI:10.1038/NChemBio.687






