北京基因组所(国家生物信息中心)揭示5hmC在泌尿生殖系统肿瘤中的表观调控机制
DNA 5-羟甲基胞嘧啶 (5hmC) 是由组织特异性的 5mC动态氧化过程产生的,并且在包括泌尿生殖系统肿瘤在内的多种癌症中发生了5hmC的丢失。然而,5hmC存在细胞特异性,且其特异性可能存在于分化的肿瘤细胞和癌症干细胞之间。因此,5hmC与癌症相关的变化可能由肿瘤组织内不同的肿瘤细胞引起,但该生物学过程的调控机制依然存在很多未知。
中国科学院北京基因组研究所(国家生物信息中心)慈维敏团队深入分析了泌尿生殖系统肿瘤的5hmC表观基因组特征和图谱,进一步证实了5hmC的全局丢失和区域增益是泌尿生殖系统肿瘤发生的标志性表观遗传事件。相关研究成果以“Regional gain and global loss of 5-hydroxymethylcytosine coexist in genitourinary cancers and regulate different oncogenic pathways”为题,于2022年9月20日发表在Clinical Epigenetics 杂志。
该研究通过应用一种灵敏的基于免疫沉淀的方法 (hMeDIP-seq) 来分析泌尿生殖系统(包括前列腺、尿路上皮和肾脏)肿瘤发生过程中的5hmC变化,证实了5hmC在泌尿生殖器组织中的组织特异性分布,并确定了5hmC在泌尿生殖器癌症中发生了区域性增加和整体水平的下降,且区域性升高的基因在调节干性和缺氧方面较为富集,并都与不良的临床预后相关。通过与传统的二维(2D)刚性培养皿相比,在软纤维蛋白凝胶诱导的3D肿瘤球体中发现细胞具有肿瘤干细胞样表型,并且在两种前列腺癌细胞系22RV1和PC3中发现5hmC的水平升高。通过合并3D体系培养的细胞和组织的5hmC富集的基因,定义了一个癌症干细胞样细胞的恶性特征,这可以预测更差的临床结果并确定来自前列腺癌肿瘤的表型恶性细胞群。值得注意的是,抗氧化维生素C衍生物抗坏血酸磷酸镁可恢复5hmC并导致前列腺癌细胞系凋亡,从而杀死癌症干细胞样细胞。通过使用5hmC重编程药物维生素 C 可以对前列腺癌进行表观遗传分化治疗。
以上结果表明,部分5hmC的增高参与维持了癌症干细胞样细胞的特征,并且和不良预后相关,同时通过使用5hmC重编程药物维生素C可以对前列腺癌进行表观遗传分化治疗。
中国科学院北京基因组研究所(国家生物信息中心)慈维敏研究员为本文通讯作者。慈维敏课题组博士生齐杰、副研究员史悦、博士生谭耶真为本文的共同第一作者。该研究得到了国家重点研发计划、中科院战略先导科技专项、国家自然科学基金等项目资助。
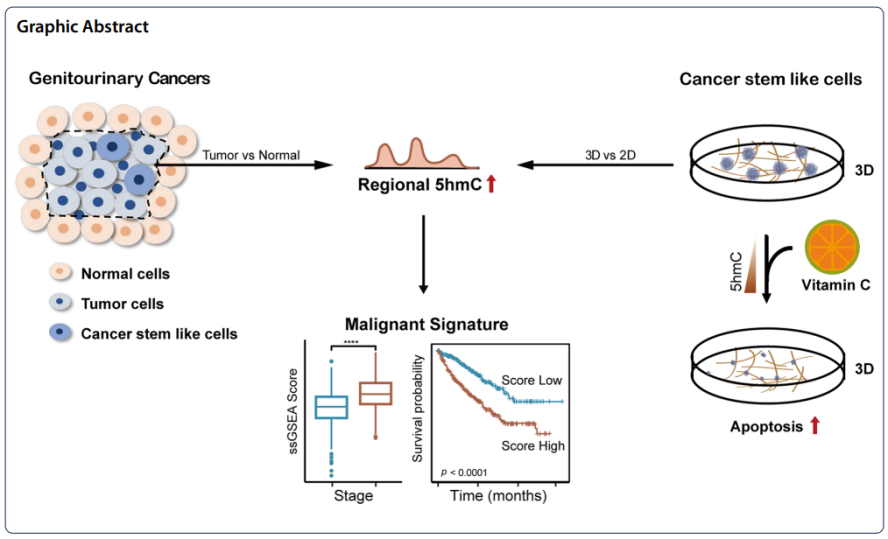
5hmC 的全局丢失和区域增益是泌尿生殖系统肿瘤发生的标志性表观遗传事件






