T细胞识别的鳞状细胞癌抗原3(SART3)促进同源重组修复
DNA双链断裂(DSBs)是最为严重的基因组损伤类型之一,若未能及时、准确地修复,将导致染色体片段缺失、易位或倒位,破坏基因结构与功能,严重威胁细胞存活。因此,高效修复DSBs对于维持细胞正常功能和确保遗传信息稳定传递至关重要。细胞主要通过同源重组(HR)和非同源末端连接(NHEJ)修复DSBs。近来研究发现,在DSB修复过程中,会暂时形成一个R-loop结构,这是一种由DNA-RNA杂交链和单链DNA共同组成的三链核酸结构,能保护DSB末端剪切产生的单链DNA免受核酸酶的降解。然而,作为HR修复的必需中间体,该DNA-RNA杂交链需要被及时移除,以便单链DNA结合蛋白RPA以及下游HR因子被招募到DSB位点完成DSB修复。目前已发现一些解旋酶,如DEAD-box RNA解旋酶DDX1等参与DNA-RNA杂交链的移除,然而关于这些解旋酶是如何被富集到DSB位点发挥及时的解旋功能还不清楚。
3月6日,国家生物信息中心应用发展部郭彩霞团队与中国科学院动物研究所/北京干细胞与再生医学研究院唐铁山团队合作,在《自然通讯》(Nature Communications)上在线发表了题为“SART3 promotes homologous recombination repair by stimulating DNA-RNA hybrids removal and DNA end resection”的研究论文。该研究揭示了T细胞识别的鳞状细胞癌抗原3(SART3)在DSB位点DNA-RNA杂交链及时移除和DNA末端剪切中的重要作用,是在团队前期报导的SART3促进跨损伤DNA合成基础上的进一步深入。
SART3是一个在多种癌症组织和恶性肿瘤细胞中高表达,而在除睾丸和胎肝外的正常组织均不表达的蛋白,以往研究报道,SART3来源的部分表位肽可特异性诱导HLA限制性细胞毒性T淋巴细胞产生杀瘤效应,有望作为一种重要的肿瘤排斥抗原用于肿瘤免疫治疗。该研究中,研究人员利用亚细胞激光微辐照技术和ChIP-qPCR等实验手段,发现SART3能够通过PAR化和DNA-RNA杂交链依赖的方式被招募至DSB位点。敲低SART3会显著降低HR修复效率,增加细胞对喜树碱、依托泊苷、羟基脲和奥拉帕尼等化疗药物的敏感性。
进一步研究发现,SART3通过双重机制调控HR修复:一方面,SART3通过与DDX1结合,介导DDX1招募到DSB位点,促进DDX1与DNA-RNA杂交链的结合,从而调控DSB位点附近的DNA-RNA杂交链水平;另一方面,SART3通过其N端的HAT4-7区域结合USP15,并通过C端的RRM区域结合BARD1,促进损伤诱导后USP15与BARD1的互作、BARD1的去泛素化以及BRCA1/BARD1复合物在损伤位点的滞留,从而促进DNA末端切除。此外,本研究还发现了一种与癌症相关的SART3突变体(SART3-R836W),其无法结合DDX1,表现出HR修复缺陷。
综上所述,这项研究不仅揭示了SART3在DSB修复中的新功能,还为癌症治疗提供了新的潜在靶点。
国家生物信息中心郭彩霞研究员和中国科学院动物研究所唐铁山研究员为本文的共同通讯作者,国家生物信息中心博士毕业生傅慧和黄敏为共同第一作者。该研究得到了国家自然科学基金、国家重点研发计划、中科院先导专项等项目资助。
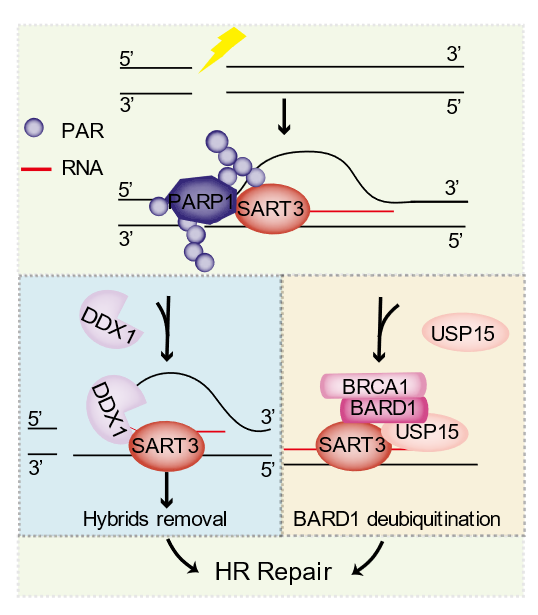
SART3调控HR修复模式图






