北京基因组所(国家生物信息中心)合作揭示天然免疫蛋白MAVS在调控人干细胞衰老方面的分子机制
近日,中国科学院北京基因组研究所(国家生物信息中心)张维绮研究组联合中国科学院动物研究所刘光慧研究组和曲静研究组,阐述了天然免疫蛋白MAVS在调控人干细胞衰老方面的分子机制。这项研究揭示了MAVS在不依赖于天然免疫应答的情况下,通过维持线粒体结构功能稳态,对人干细胞的衰老调控发挥重要作用。相关成果以“MAVS antagonizes human stem cell senescence as a mitochondrial stabilizer”为题发表于Research。
MAVS是一种定位于线粒体膜上的抗病毒信号蛋白,在抵抗RNA病毒感染中起着关键作用。目前,针对MAVS参与天然免疫调控以应对病毒感染的功能研究已十分广泛。但是作为天然免疫通路中关键的开关分子,MAVS是加速还是延缓人类干细胞衰老?此外,作为一个定位于线粒体的蛋白,MAVS是否与线粒体稳态息息相关,进而调控干细胞的功能?回答这些问题,将加深我们对于天然免疫通路、线粒体生物学和衰老生物学的认识,揭示天然免疫、线粒体稳态和干细胞衰老之间的深层联系。
值得注意的是,线粒体功能障碍是衰老的重要特征之一,越来越多的证据表明,线粒体功能失调与干细胞耗竭和细胞衰老密切相关。因此,挖掘线粒体结构功能稳定因子,对于延缓细胞和机体衰老具有重要意义。尽管MAVS作为线粒体膜上的重要蛋白,但是其在人干细胞中的线粒体相互作用蛋白谱尚未得到刻画,是否参与线粒体稳态调控作用没有得到揭示,特别是其在人干细胞衰老调控中的作用和机制尚不明确。
为了研究MAVS在多种人类干细胞中的功能,研究人员利用CRISPR/Cas9基因编辑技术和干细胞定向诱导分化技术,首次获得了靶向敲除MAVS 的人胚胎干细胞、人神经干细胞和人间充质干细胞。尽管MAVS的缺失不影响人胚胎干细胞和人神经干细胞的自我更新和分化,但MAVS敲除的人间充质干细胞则表现出一系列加速衰老的表型,提示MAVS对于维持人干细胞功能具有细胞类型特异性,且人间充质干细胞对MAVS的缺失更为敏感。
鉴于MAVS在激活天然免疫通路方面的已知功能,研究人员首先在MAVS敲除的人间充质干细胞中检测了其经典下游NF-κB、IRF3和IFNα的信号应答状态。研究人员发现这些通路均呈下调状态,同时衰老相关分泌表型(SASP)水平也降低,这表明MAVS的缺失在一定程度上抑制了下游的免疫炎症反应。这些现象引发了研究人员进一步的思考:MAVS的敲除究竟导致了什么细胞分子缺陷,以至于细胞即使在SASP促炎机制被抑制的情况下,仍能强力驱动细胞老化呢?而且,作为一个线粒体定位的蛋白,MAVS是否能调控线粒体的稳态,进而调控间充质干细胞衰老呢?带着这些问题,研究人员开展了深入的研究。结果显示MAVS敲除的人间充质干细胞表现出线粒体数量增多、异常线粒体比例增加的现象,这表明线粒体结构受到破坏;同时,线粒体膜电势下降、线粒体ROS增加以及线粒体氧化呼吸速率明显下降,提示MAVS缺失会导致线粒体功能缺陷。
机制分析显示,MAVS与线粒体融合相关蛋白OPA1存在相互作用。同时,在MAVS缺失后,OPA1蛋白水平下调,并在干细胞衰老模型中也观察到了MAVS与OPA1蛋白水平的下调。研究人员进一步验证了MAVS-OPA1轴在维持线粒体稳态和调控人干细胞衰老方面的作用,结果显示敲低OPA1能模拟MAVS缺失造成的线粒体结构和功能损害,导致细胞出现加速衰老的特征。此外,在MAVS敲除的人间充质干细胞中回补OPA1或MAVS本身,细胞的线粒体结构和功能稳态得以恢复,衰老表型也得以延缓。总体而言,该研究揭示了MAVS通过稳定OPA1来维持线粒体稳态,从而调控人干细胞衰老。
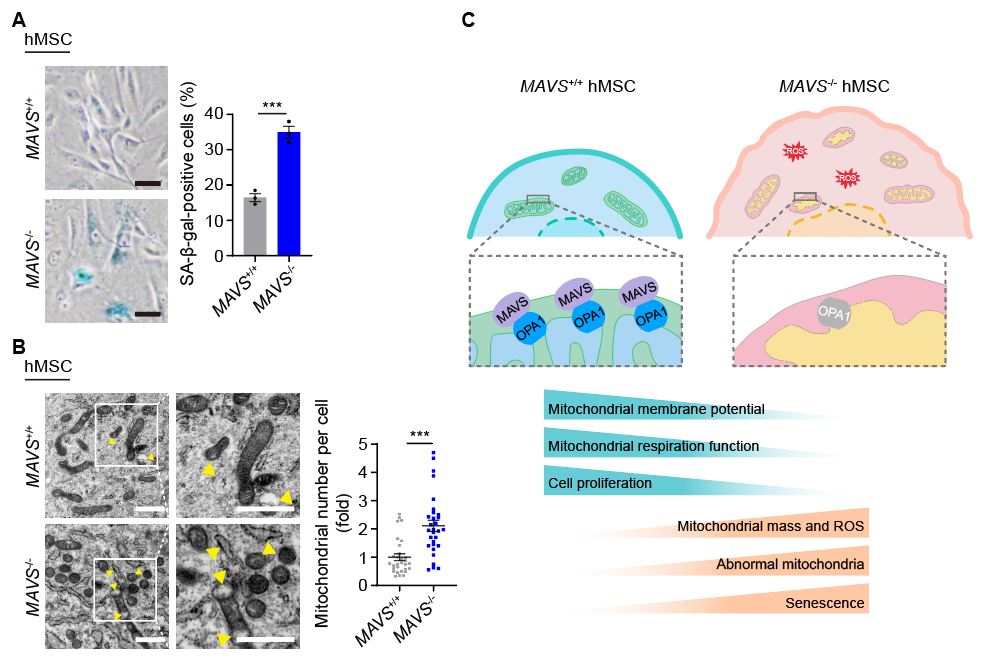
MAVS通过稳定OPA1来维持线粒体稳态进而调控人干细胞衰老。A. MAVS缺失加速人间充质干细胞衰老。B. MAVS缺失导致线粒体稳态失调。C. MAVS-OPA1轴调控线粒体稳态和人干细胞衰老模式图
本研究揭示了天然免疫通路相关蛋白MAVS在调控人干细胞衰老和维持线粒体稳态方面所具备的非经典功能,为MAVS蛋白功能提供了新见解,同时也为延缓干细胞衰老以及防治衰老相关疾病提供了新的思路和线索。进一步的研究还需深入探究MAVS在不同层面对线粒体进行精细调控的机制,以及在衰老过程中如何协调其在抗病毒免疫应答和线粒体稳态调控方面的作用。
中国科学院北京基因组研究所(国家生物信息中心)博士研究生王翠、硕士研究生杨宽,中国科学院动物研究所助理研究员刘晓倩为文章的共同第一作者。中国科学院北京基因组研究所(国家生物信息中心)张维绮研究员、中国科学院动物研究所刘光慧研究员和曲静研究员为论文的共同通讯作者。