北京基因组所(国家生物信息中心)合作发现冠心病非脂质通路分子亚型致病新基因
冠心病是严重危害人类健康的常见心血管疾病,也是导致全球人类死亡的主要原因之一。这一疾病受基因组常见变异和罕见变异的共同复杂影响,遗传因素对疾病的作用程度约为50%~70%。解析冠心病发生背后的遗传基础和机制,是依据基因组医学对疾病进行精准分型,进而依据遗传致病因素对疾病进行个性化治疗的基础。随着测序技术的快速发展和成本的降低,大规模人群测序数据的产生使得深入解析冠心病遗传基础成为可能。
为进一步识别冠心病相关致病基因以及开展基于基因遗传信息的疾病风险预测,北京基因组研究所(国家生物信息中心)汪敏先研究组与博德研究所(Broad Institute of MIT and Harvard)Amit V. Khera研究组展开合作研究,基于4.1万例冠心病患者和21.7万例对照组的全外显子组基因测序数据和心血管疾病相关临床风险因素等疾病电子病历数据,开展基于基因编码区功能变异的关联富集分析(图1),发现内皮一氧化氮合成酶基因(NOS3)为冠心病的非脂质分子亚型。相关研究成果以“Gene Sequencing Identifies Perturbation in Nitric Oxide Signaling as a Nonlipid Molecular Subtype of Coronary Artery Disease”为题在国际期刊Circulation: Genomic and Precision Medicine发表。
该研究基于超大规模的样本量更加有效地检测出基因编码区上的罕见变异,这些编码蛋白质的罕见变异能够改变蛋白质表达、结构或功能,对疾病风险产生较大影响。同时,该研究将位于同一个基因上的所有罕见变异根据功能影响类型聚为一个集合,比较该基因上的变异总频率在患病组和对照组之间的差异(图1),该方法能够高效分析基因与疾病表型之间的因果关系,克服了传统关联分析研究(GWAS)虽能定位基因组区域,但无法精确定位致病基因的缺点,从而为下游实验机制验证及药物开发提供了遗传机制明晰的靶点。
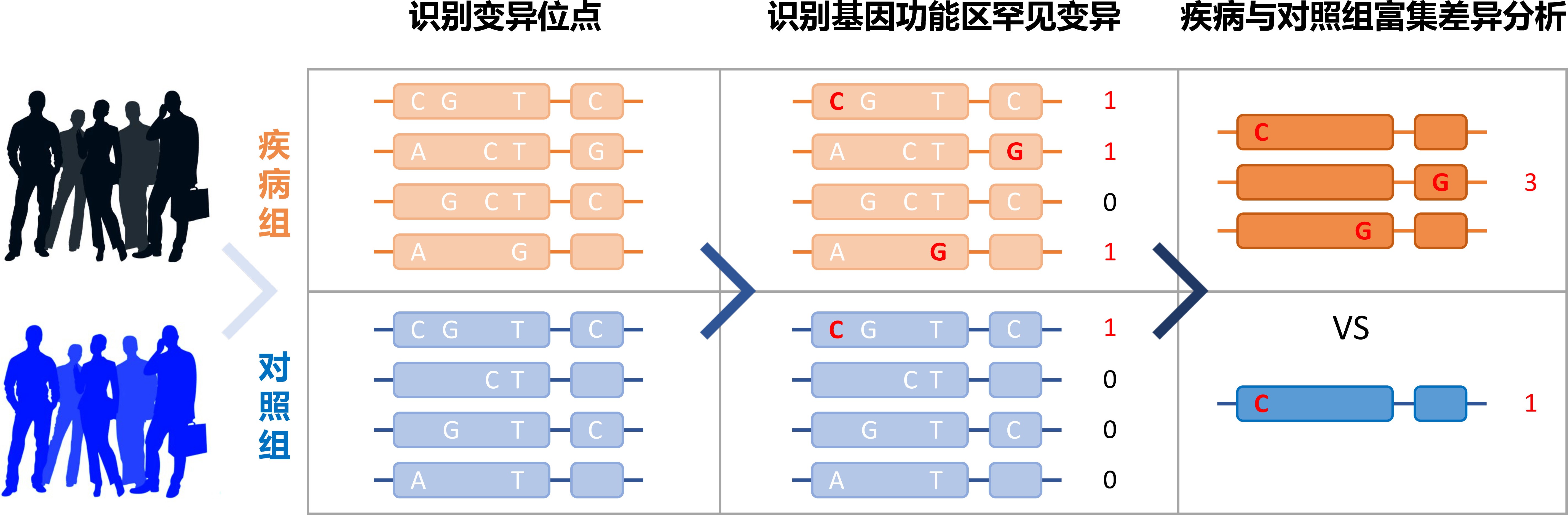
图1. 通过分析基因编码区功能变异富集差异发现致病风险基因的流程示意图
该研究鉴定出低密度脂蛋白受体基因(LDLR,与低密度脂蛋白胆固醇代谢相关)的罕见变异与冠心病最密切相关(图2)。在0.34%的对照组中发现LDLR变异,然而在0.91%的冠心病患者中发现了LDLR变异,矫正年龄、性别等混杂因素的影响后,携带者的患病风险增加了4.4倍。同时,该研究还发现了一种与LDLR不同的非脂质分子亚型,即与内皮一氧化氮合成酶基因(NOS3)相关的遗传变异,是冠心病风险的另一个非常重要的驱动因素(图2),0.59%的冠心病患者存在NOS3变异,对照组为0.41%,矫正混杂因素后,基因变异携带者的患病风险增加了约2.4倍。利用中间分子表型对疾病致病的机制解析表明,NOS3主要通过影响血压增加冠心病风险,与传统的血脂相关通路无显著相关性。
该研究由中科院北京基因组研究所(国家生物信息中心)、博德研究所(Broad Institute of MIT and Harvard)、哈佛大学医学院、美国麻省总院等机构合作完成。博德研究所Amit V. Khera教授与北京基因组研究所(国家生物信息中心)汪敏先研究员为并列第一作者,博德研究所Amit V. Khera教授为本研究的通讯作者。
为进一步增加该研究方法的统计效力,合作研究团队正在对近5万冠心病患者及近51万的对照数据进行新一轮升级分析,从增大样本量和构建分析新方法、新工具等多个维度,提升发现致病新基因的能力。同时,研究组希望和更多单位开展合作,共同推进对冠心病等心脑血管疾病遗传基础和机制的研究,促进对心脑血管疾病的精准干预和个性化治疗。
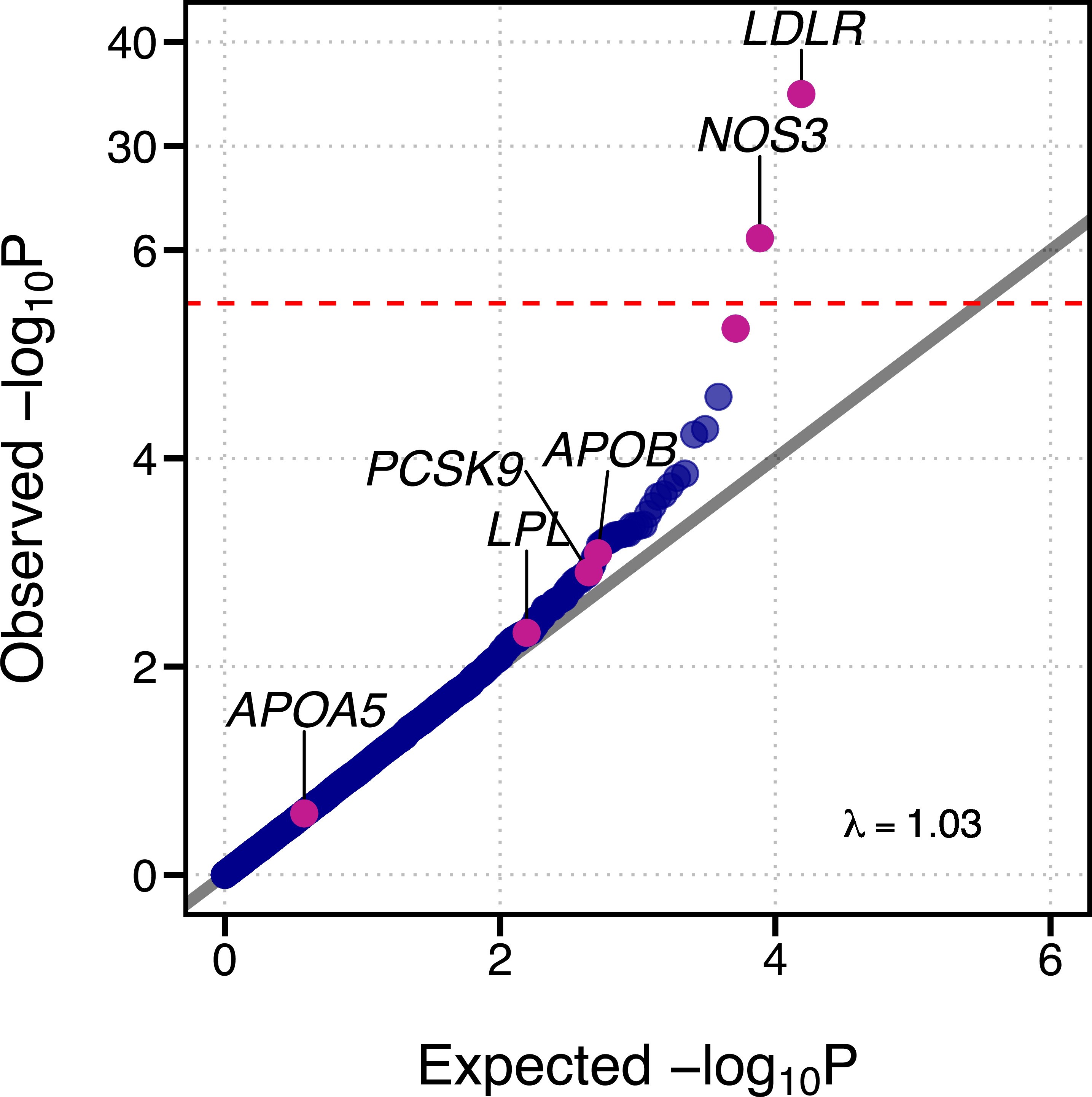
图2. 依据基因突变在疾病与对照组间的富集差异程度排序的基因列表。红色虚线表示全基因组显著水平,P Value = 2.5x10-6






