北京基因组研究所(国家生物信息中心)合作揭示年轻血液促进干细胞及机体年轻化的分子机制
衰老是一种涉及全身多种组织器官系统性退化的过程,表现为渐进性机体再生能力减弱及功能衰退。异体共生(Heterochronic parabiosis)是通过外科手术连接年老和年轻小鼠的循环系统所构建的模型。可用于评价老化的机体受年轻血液影响后如何恢复活力,反之亦可用于研究年轻的组织和器官受衰老血液影响后加速退行。年轻血液究竟靠何种力量使衰老个体重返“年轻态”的秘密还有待揭示。相关的重要科学问题包括:哪些衰老的器官、组织和细胞类型可以或者更容易被年轻血液“返老还童”?衰老干细胞的活力是否能被年轻血液增强?能否发现介导年轻血液效应的“年轻因子”,并以此作为干预器官衰老的新型分子靶标?
2022年5月24日,中国科学院北京基因组研究所(国家生物信息中心)张维绮研究组同中国科学院动物研究所刘光慧研究组、曲静研究组合作,于Cell Stem Cell杂志在线发表题为“Heterochronic parabiosis induces stem cell revitalization and systemic rejuvenation across aged tissues”的研究论文。该研究通过构建年老小鼠和年轻小鼠的异体共生模型,绘制了系统水平的单细胞转录组图谱,并对骨髓、脾脏、外周血、脑、肝脏、骨骼肌和皮肤等7种组织器官进行了深入解析。
研究发现,暴露于年老个体的血液可以使年轻个体的不同器官、组织和细胞类型呈现加速衰老的特征。而年老个体受年轻血液影响则呈现出典型的“年轻化”改变,主要表现为衰老组织微环境的改善及相应干(祖)细胞的激活。被激活的干(祖)细胞群体包括皮肤的基底细胞和毛囊干细胞、骨骼肌的成纤维/脂肪祖细胞,以及定位于骨髓的HSPC。其中,衰老的HSPC对年轻血液的反应尤为敏感。结合差异基因表达、核心调控转录因子和细胞-细胞间通讯分析,研究团队发现了一系列以表观调控基因YY1以及细胞趋化因子CCL3为代表的HSPC衰老调控因子。结果显示,YY1的表达降低与HSPC老化密切相关,但其表达水平对年轻血液刺激缺乏足够响应性,而在衰老HSPC中被抑制的CCL3则可以被年轻血液诱导激活。进一步的小鼠移植实验发现,慢病毒介导的YY1过表达可有效增强年老的造血干(祖)细胞的重建能力;而基于CCL3过表达的“基因疗法”可显著提高年老造血干(祖)细胞向淋系分化的能力。上述研究表明,暴露于年轻血液可有效改善老年个体不同器官的组织微环境,并恢复多种成体干细胞的活力。其中,造血干(祖)细胞(HSPC)是对年轻血液尤为敏感的细胞类型之一,年轻的血液可以通过上调趋化因子CCL3的表达促进衰老HSPC的“年轻化”。
该研究以单细胞分辨率、跨器官、多维度的形式系统解析了异体共生模型中年轻血液促使老年个体“年轻化”以及年老血液加速年轻个体“老化”的细胞分子变化规律,揭示了年轻体内环境促进年老组织再生的关键介导因子,为发展衰老预警和干预的关键标志物和新型策略提供了丰富的数据资源以及重要线索和思路。同时,该工作也为从系统生物学角度发现机体“年轻化因子”提供了新的研究范式,在科学应对老龄化方面具有潜在的应用价值。
该项研究由中科院动物所、中科院北京基因组所、中科院干细胞与再生医学创新研究院、北京干细胞与再生医学研究院、首都医科大学宣武医院、清华大学、中国农业大学、北京协和医院等机构合作完成。中科院动物所刘光慧研究员、中科院北京基因组研究所张维绮研究员、和中科院动物所曲静研究员为共同通讯作者。中科院动物所马帅副研究员、首都医科大学宣武医院王思研究员、中科院动物所叶燕霞助理研究员、中科院北京基因组研究所任捷研究员以及清华大学陈瑞轻博士为并列第一作者。研究得到清华大学王建伟教授、首都医科大学宣武医院陈彪教授、中科院动物所宋默识研究员、中国农业大学于舒洋教授的合作及支持。该研究获得科技部、国家自然科学基金委、中国科学院和北京市科委等项目资助。
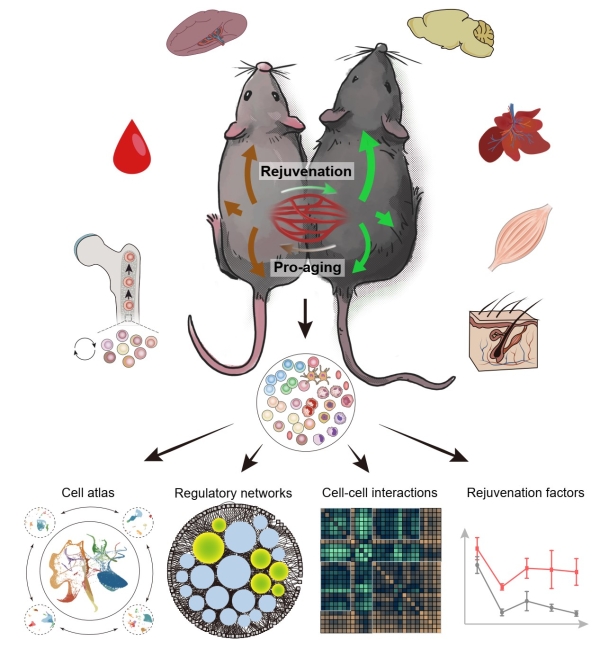
年轻血液促进机体多组织年轻化的系统生物学研究
附件下载:






