北京基因组所合作建立基于CRISPRi/dCas9的脑内多基因同时抑制系统
近期,中国科学院北京基因组研究所米双利研究组与清华大学生命科学学院姚骏研究组合作,建立了动物脑内基于CRISPR interference (CRISPRi)的多重基因条件性敲低平台,为在体研究复杂蛋白复合物的功能和多基因神经疾病的发病机理提供了重要的工具。该成果于2018年2月在Nature Neuroscience杂志在线发表。
基因特异性的失活策略是基因功能研究的重要方法,以CRISPR/Cas9为代表的基因编辑工具已被广泛用于建立转基因细胞株和动物模型。随着基因功能研究的发展,单一基因的敲除/敲低已经不足以满足研究者的要求,尤其是对于复杂的多蛋白复合物和多基因神经疾病,多重基因元素失活的条件性组合搭配正日益成为主流需求。然而,逐一构建不同基因的敲除/敲入动物模型再进行杂交,受限于低下的制备效率、冗长的制作周期和昂贵的成本费用,已成为研究中的主要瓶颈之一。另外,CRISPR/Cas9切割后产生的非同源末端连接修复常常导致非特异性的删除、插入或其它突变,导致在单细胞水平产生多种表型变化,例如杂合型、纯合失活型和野生型等,可能会对后续实验产生严重的干扰。
在该研究中,研究人员利用病毒传递策略,针对神经元构建了优化的基于dCas9的CRISPRi系统,达到在小鼠脑内进行高效且靶向特异性的抑制功能基因表达的目的。该系统能够在神经元的单细胞水平获得均一的表型,而且在基因沉默能力上显著优于传统的RNAi技术。同时,利用sgRNA相隔错配的策略,在神经元中实现了精确的靶向特异性基因抑制,几乎不产生脱靶效应。
研究人员进一步在动物脑内拓展了该技术的应用。利用神经元亚群特异性的启动子,条件性控制功能基因Syt1在海马齿状回兴奋性和抑制性神经元中的独立失活,实现了对局部神经网络兴奋/抑制平衡的双向调节。最后,研究人员开发了基于一体化载体和双载体的两套CRISPRi多重基因抑制系统,分别成功实现了小鼠脑内syt1及其互作网络蛋白共5重基因的同时抑制,且能够实现灵活多变的多基因不同组合的高效失活。
该研究证实,针对神经元的CRISPRi能够在动物出生后的各个阶段以及不同生理及病理状态下实现在体操作,建立细胞和动物模型,解析多重基因及基因通路与复杂表型之间的关系。该成果为探索复杂脑疾病的致病机理,寻求新型治疗策略,提供了灵活而高效的基因编辑工具。
该研究获得了科技部重点研发专项、国家自然科学基金、中国科学院精准基因组医学重点实验室开放课题等基金的资助。
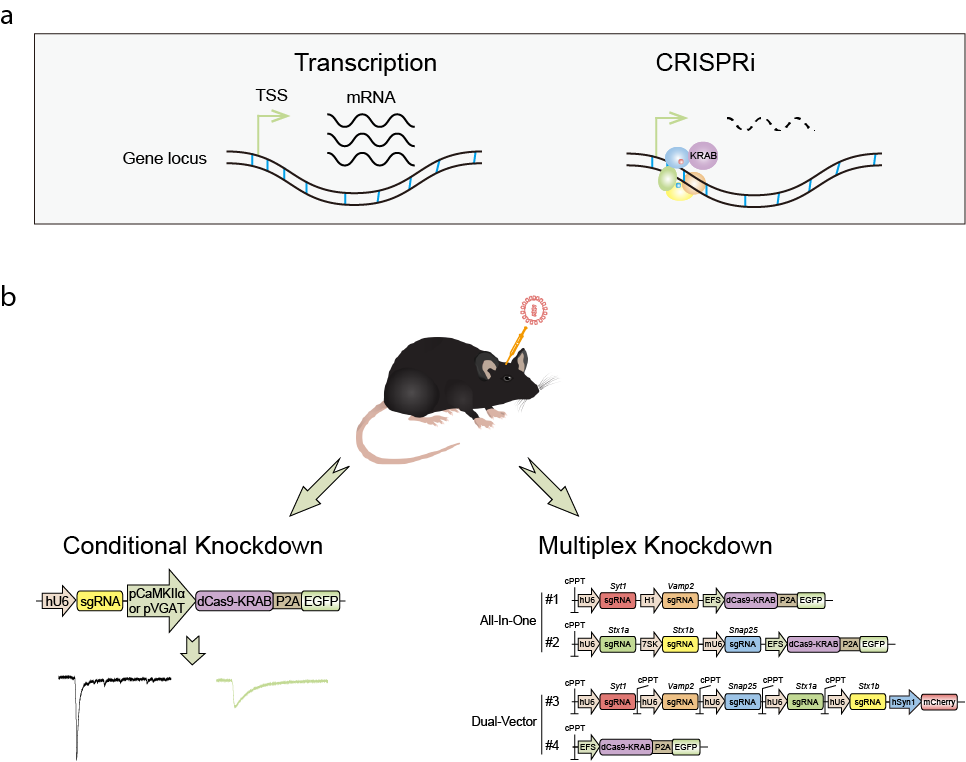
CRISPRi在小鼠脑内进行条件性敲低和多重敲低的设计示意图