基因组所RNA甲基化表观遗传新机制研究获重要进展
11月21日,中国科学院北京基因组研究所重大疾病基因组与个体化医疗实验室杨运桂研究组,与美国芝加哥大学何川教授实验室和奥斯陆大学Arne Klungland教授合作完成的“RNA甲基化表观遗传新机制研究项目”取得重要进展,相关学术论文在Cell子刊《Molecular Cell》杂志以“ALKBH5 is a Mammalian RNA Demethylase that Impacts RNA Metabolism and Mouse Fertility”为题在线发表。本研究工作为可逆RNA甲基化作为一种新的表观遗传调控机制提供了直接生物学证据,为代谢性疾病、生殖发育和恶性肿瘤的早期诊断与有效治疗提供了新的思路和研究方向。
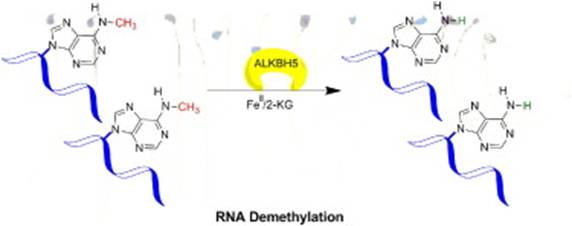
本论文所关注的6-甲基腺嘌呤【N6-methyl-adenosine(m6A)】是高等生物中含量最为丰富的一种RNA甲基化形式,其甲基化由SAM类甲基化转移酶催化而成。m6A是mRNA中存在的主要甲基化形式,可能参与mRNA剪接、运输等加工过程,但mRNA中m6A的生物学功能并不清楚。本研究工作从生化,基因组学、细胞及模式生物多层次水平上,发现和鉴定了第二个m6A去甲基化酶-与FTO同属加双酶AlkB家族的ALKBH5,进一步证实了可逆m6A甲基化调控mRNA表达水平和RNA代谢过程;ALKBH5敲除小鼠生精小管细胞中mRNA的m6A甲基化水平升高,同时引起睾丸萎缩,精子数量减少,质量下降,生育率下降等病变,证实ALKBH5介导的RNA m6A去甲基化调控精子发育等重要生理功能。
2010年6月,由杨运桂研究员及奥斯陆大学Arne Klungland教授共同发起,中国科学院北京基因组研究所与挪威奥斯陆大学联合成立了“BIG-OSLO基因组结构和稳定性联合实验室”,旨在互惠合作的基础上,推动在基因组学,分子细胞生物学等领域的共同发展。本研究工作即为双方与美国芝加哥大学何川教授实验室合作项目之一,三方利用各自在细胞,基因组学,动物模型,及化学生物学方面的优势,对ALKBH5作为RNA m6A去甲基化酶活性与生物学功能进行了系统研究。2011年杨运桂研究员实验室与何川教授实验室合作,发现了该甲基化形式的第一个去甲基化酶——肥胖基因FTO,首次证实了m6A甲基化修饰的动态可逆性(Jia G. et al. Nature Chemical Biology, 2011)。
DNA甲基化是一种重要的表观遗传标记在基因功能调控中的作用性受到了一致的认可,同时也是近年来的研究热点。相对而言,RNA甲基化虽然种类繁多,普遍存在于各种高级生物中,但是由于多年来缺乏有效的检测手段,所以相关的研究一直停滞不前,RNA甲基化的生物学功能也一直未能引起足够重视。在过去的十数年里,直到目前为止科学家们都只将RNA修饰作为一种微调控基因表达的机制。两种RNA m6A去甲基化酶的发现和鉴定,及它们所调控的生物学功能的多样性,证明m6A是一种动态可逆RNA修饰方式,m6A甲基化水平的变化与RNA代谢和功能发挥有密切的关系。
该项工作得到了科技部、国家自然科学基金委、中国科学院及教育部经费的支持。
文章链接:http://www.sciencedirect.com/science/article/pii/S1097276512008921