北京基因组所混合性白血病基因组研究获进展
近日,中国科学院北京基因组研究所王前飞研究员与美国芝加哥大学血液学教授Michael J. Thirman合作开展的“MLL融合蛋白在急性白血病中的致病机制研究”取得阶段性进展,其研究论文《MLL融合蛋白在白血病基因组中选择性调控MLL野生型的部分靶基因》(MLL Fusion Proteins Preferentially Regulate a Subset of Wild Type MLL Target Genes in the Leukemic Genome),于2011年4月在BLOOD杂志发表。该项成果的发布揭示了MLL融合蛋白通过选择性调控野生型MLL蛋白的部分靶基因而推动急性白血病发生的致病机制,为我国白血病及其肿瘤基因组研究起到了积极推动意义。
MLL白血病是一类预后不良的血液系统恶性肿瘤,由于染色体易位形成MLL融合蛋白而得名。野生型MLL(Mixed Lineage Leukemia)基因编码一种组蛋白甲基转移酶,通过催化H3K4甲基化而激活一系列在血细胞分化和发育过程中起关键作用的基因表达。染色体易位后形成的MLL融合蛋白通过募集组蛋白甲基转移酶DOT1L来催化H3K79甲基化,引起全基因组转录表达的紊乱。然而,失衡的转录组中哪些是MLL融合蛋白的直接靶基因和关键的致病通路,目前尚未有较系统和全面的研究。
为了阐述这一重要问题,王前飞研究员及其实验室成员通过采用两套平行方案,即比较人源白血病细胞系的MLL结合、联合分析可诱导MLL-ENL小鼠模型的靶基因定位与表达谱,发现了MLL融合蛋白结合的靶基因是野生型MLL蛋白靶基因的一部分(图A)。研究还发现,在诱导MLL-ENL小鼠模型中,MLL融合蛋白的结合与H3K79甲基化水平的改变仅局限于部分基因组区域,并由此界定了223个MLL-ENL结合的靶基因。令人吃惊的是,在诱导产生MLL-ENL融合蛋白后,MLL融合蛋白结合的绝大部分靶基因没有显示出mRNA表达水平的显著改变;只有12个靶基因的mRNA水平显著升高,被定义为MLL-ENL调控靶基因。这些关键的靶基因中除了已知的HOXA9/MEIS1, 研究还发现了转录因子EYA1、SIX1和SIX4是MLL-ENL的直接靶点,而且EYA蛋白已知能与SIX蛋白家族成员形成异二聚体,因此提示了EYA1/SIX1很可能是急性白血病中MLL融合蛋白介导的一种新的致病通路。研究人员进一步通过造血细胞转化实验证明了EYA1与SIX1协同作用能使造血祖细胞在体外永生化(图B)。
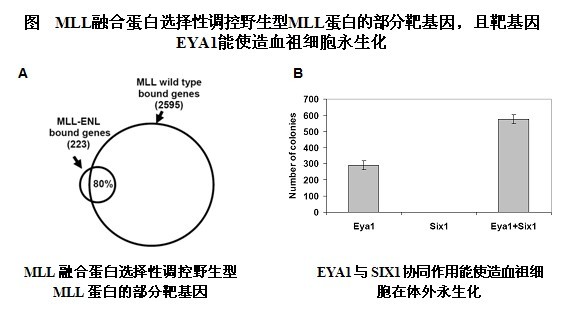
总之,该研究揭示了MLL融合蛋白通过选择性调控野生型MLL蛋白的部分靶基因而推动急性白血病发生的致病机制,表明了EYA1/SIX1很可能是急性白血病中MLL融合蛋白介导的一种新的致病通路,为深入开展白血病的转录调控机理研究奠定了良好基础。目前,该实验室正综合运用ChIP-seq和RNA-seq系统研究MLL白血病中关键的microRNA靶基因和相关的转录调控网络,并对MLL白血病病人进行全基因组重测序。期望联合实验血液学以及强大的基因组学技术平台,解读正常与白血病基因组,并由此加深对人类癌症的理论认识,为设计分子手段治疗血癌提供可能的靶点。
论文链接:






