R-loop是一种由RNA:DNA杂合链和单链DNA组成的特殊核酸结构,在原核和真核生物的基因组中分布广泛且普遍存在。R-loop在很多关键的生物学过程中发挥重要功能,包括染色质修饰、转录调控、DNA损伤修复以及基因组稳定性等,但其如何被精确调控的机制尚不清楚。m6A修饰作为信使RNA上丰度最高的修饰类型,广泛参与哺乳动物的发育、免疫、干细胞更新、脂肪分化、以及肿瘤生成和转移等生命过程。然而,目前尚不清楚m6A是否能作为R-loop中RNA组分的本源特征来调控R-loop水平,进而发挥各种生物学功能。
中科院北京基因组研究所杨运桂、任捷与清华大学生科院孙前文团队合作研究,发现m6A能稳定R-loop的形成,进而调控基因转录的有效终止。这一成果以《m6A promotes R-loop formation to facilitate transcription termination》为题于10月12日在线发表于《细胞研究》(Cell Research)杂志。
研究团队首先通过斑点分子杂交和免疫荧光技术,发现敲低m6A甲基转移酶METTL3显著降低R-loop水平,且该调控作用依赖于METTL3甲基转移酶活性。随后,团队成员利用高效液相色谱联合质谱技术,发现相较于染色体结合的RNA(caRNA),R-loop的RNA组分有更加富集的m6A修饰。进一步利用基于单链DNA建库的DNA:RNA杂合链免疫共沉淀高通量测序技术(ssDRIP-seq),发现下调的R-loop主要富集在转录终止区域,R-loop变化程度与m6A的距离和修饰水平相关。为了探索m6A对R-loop调控的生物学功能,研究团队绘制了RNA聚合酶转录位点的高分辨率图谱,并在MYC、ACTIN基因上进行多种转录活性检测,发现m6A促进R-loop形成是转录终止阶段的关键步骤,可以防止RNA聚合酶的转录通读。最后,团队成员构建了针对转录通读的报告基因系统,通过m6A修饰位点的突变进一步证实m6A对于R-loop形成及转录终止的关键作用。
该研究发现了m6A甲基化修饰的共转录调控功能,揭示了RNA甲基化修饰对染色质结构的影响,以及R-loop结构中的RNA组分被修饰后对其自身稳态的调控机制,阐释了m6A通过稳定R-loop而促进转录正常终止的现象,为进一步研究m6A与R-loop的调控机制和相应生物学功能提供了基本的技术和理论支撑。
该研究得到了中国科学院战略性先导科技专项、国家自然科学以及国家重点研发计划等基金资助。
论文链接
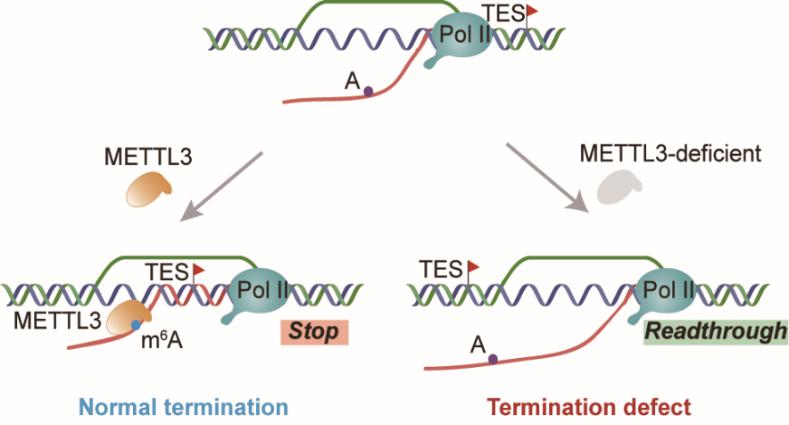
m6A甲基化修饰调控R-loop的形成及转录终止机制


