胰腺导管腺癌(PDAC)被称为“癌中之王”,早期诊断困难、治疗效果欠佳、病死率居高不下,五年生存率仅为8.5%,具有很强的肿瘤异质性。为解决生命与健康领域重大医学科学前沿问题,2018年,中科院—北京协和医院健康科学研究中心成立。由赵玉沛院士、周琪院士担任科学顾问,中科院北京基因组研究所杨运桂团队、韩大力团队与北京协和医院吴文铭团队在健康科学研究中心支持下,为探究PDAC发生发展的分子机制以及肿瘤微环境的调控作用,通过合作研究,利用单细胞转录组测序技术,系统鉴定并分析了PDAC病人和对照胰腺样本细胞类型,阐明了胰腺癌肿瘤-微环境高度异质性特征,揭示了肿瘤亚群细胞与浸润免疫细胞间相互关系,提出了新的潜在治疗靶点。
研究团队通过对24例术前未经放化疗的人胰腺癌组织的41986个细胞及11例对照胰腺组织的15544个细胞进行单细胞转录组分析,绘制了大样本人胰腺导管腺癌细胞图谱。首先,通过t-SNE 分析鉴定出胰腺癌组织中10类细胞:I型导管细胞、II 型导管细胞、腺泡细胞、内分泌细胞、内皮细胞、成纤维细胞、星型细胞、巨噬细胞、T细胞和B细胞。通过CNV结合差异分析和功能富集,鉴定II型导管细胞是胰腺癌组织的恶性细胞。其次,利用轨迹分析研究了PDAC从癌前状态到恶性状态的基因表达模式,发现在PDAC进展过程中,包括ErbB和Notch信号通路在内的多个经典致癌通路被激活。特别是在肿瘤进展的晚期,细胞增殖和迁移的相关基因被显著激活。另外,团队在II型导管细胞中鉴定出具备高增殖、高转移潜能等在内的七个细胞亚群。其中,亚群7(增殖性导管亚群)的特征基因富集在细胞周期和细胞增殖相关通路。进一步,结合TCGA数据库的PAAD数据集进行整合分析发现,肿瘤组织中增殖性导管细胞亚群特征基因的表达水平与肿瘤浸润T细胞的激活存在显著的负相关性,病理切片染色也证明了这两群细胞数量的关联性,提示增殖性导管细胞的存在和活化T细胞的缺失可能共同导致PDAC患者的不良预后。
相关研究成果在7月4日以Single-cell RNA-seq highlights intra-tumoral heterogeneity and malignant progression in pancreatic ductal adenocarcinoma为题在Cell Research杂志在线发表。
该研究为探索胰腺导管腺癌的致病机制、揭示肿瘤微环境的作用提供了重要的组学资源,揭示了增殖性导管亚群抑制 T 细胞浸润和活化的新机制,提出了CDK1,PLK1和AURKA等增殖性导管亚群标记物作为精准治疗靶点的可行性,为胰腺癌精准诊治提供了新的研究方向。该研究得到了中国科学院战略性先导科技专项、国家重点研发计划、中国医学科学院医学与健康科技创新工程、国家自然科学基金等基金资助。
论文链接
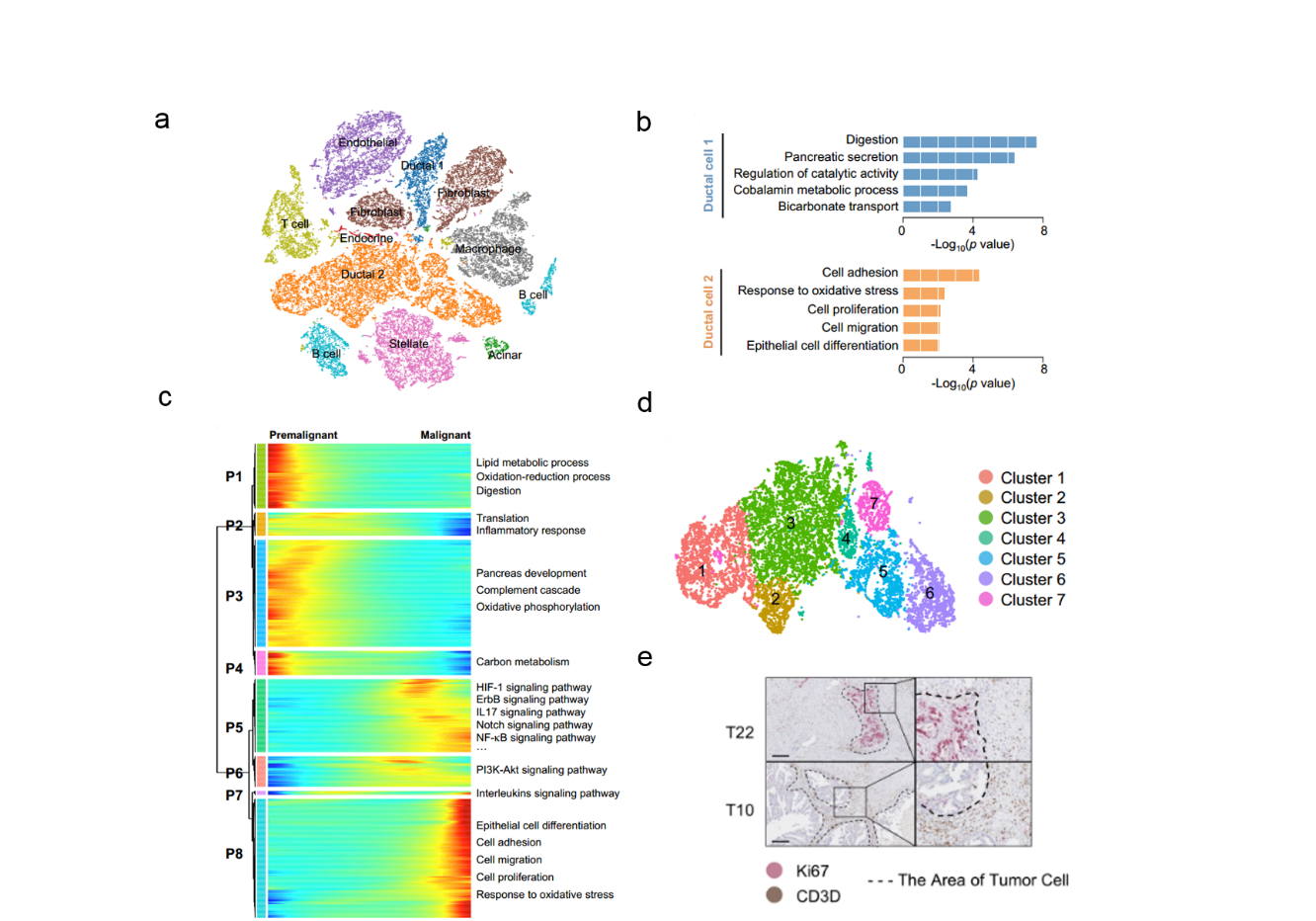
胰腺癌肿瘤-微环境高度异质性细胞特征


