肥胖相关基因(FTO)是第一个被发现在肥胖中发挥重要作用的基因,在调节体重和脂肪含量方面具有重要作用,但具体的分子机制以及是否能够利用小分子化合物抑制FTO活性来治疗肥胖相关的代谢类疾病一直以来并不清楚。
中科院北京基因组研究所杨运桂团队与北京生命科学研究所黄牛和张二荃团队合作发现,恩他卡朋,作为FDA批准认证的一种帕金森的辅助治疗药物,能够通过抑制FTO的m6A(N6-Methyladenosine)去甲基化酶活性调控能量代谢。相关研究成果在4月17日以Identification of entacapone as a chemical inhibitor of FTO mediating metabolic regulation through FOXO1为题在线发表于Science Translational Medicine杂志。
m6A修饰作为信使RNA上丰度最高的修饰类型,广泛参与哺乳动物的发育、免疫、干细胞更新、脂肪分化、以及肿瘤生成和转移等生命过程。研究团队采用基于结构的虚拟筛选方法发现了恩他卡朋能直接结合FTO并抑制其m6A去甲基化酶活性,而对另一m6A去甲基化酶ALKBH5以及DNA甲基化和组蛋白修饰的去甲基化酶没有抑制作用。研究发现小鼠在服用恩他卡朋后表现出体重显著减少、血糖水平明显降低以及脂肪组织产热明显增强等特征。随后通过转录组分析发现糖异生关键基因G6PC在FTO敲低后表达显著下调。通过分析肝脏FTO条件性敲除的小鼠中肝脏组织的转录组以及m6A的修饰谱数据后发现,在FTO条件敲除肝脏组织中FOXO1信使RNA上两个m6A修饰位点水平升高,从而调控了G6PC表达。为了进一步研究小鼠肝脏中FTO如何调控G6PC的表达,研究者通过腺病毒整合G6PC启动子荧光素酶报告系统来观察小鼠肝脏荧光成像。肝脏条件性敲除FTO或FOXO1,以及喂食恩他卡朋的小鼠都呈现出G6PC信号减弱的特征。野生型FTO能回补G6PC荧光信号而m6A去甲基化关键氨基酸突变的FTO则不能成功回补,证实了FTO-FOXO1-G6PC通路在肝脏中调控血糖变化的机制。
研究者还发现,恩他卡朋引起小鼠腹股沟白色脂肪组织(iWAT)产热增加的分子机制也同样是由于FTO受到抑制后,FOXO1信使RNA上m6A水平增加引起FOXO1蛋白表达下调所致。与肝脏组织不同的是,在脂肪组织中FOXO1对转录因子的抑制作用能上调产热关键因子UCP1的表达。UCP1启动子的荧光素酶报告基因实验证实,FTO敲低后m6A修饰水平在FOXO1信使RNA上升高,引起了FOXO1蛋白表达下调,从而上调了UCP1的表达。
该研究进一步揭示了FTO在能量代谢方面调控的分子机制,并且FTO的抑制剂恩他卡朋的发现对肥胖患者的临床用药具有一定指导意义。该研究得到了中国科学院战略性先导科技专项、国家重点研发计划以及国家自然科学等基金资助。
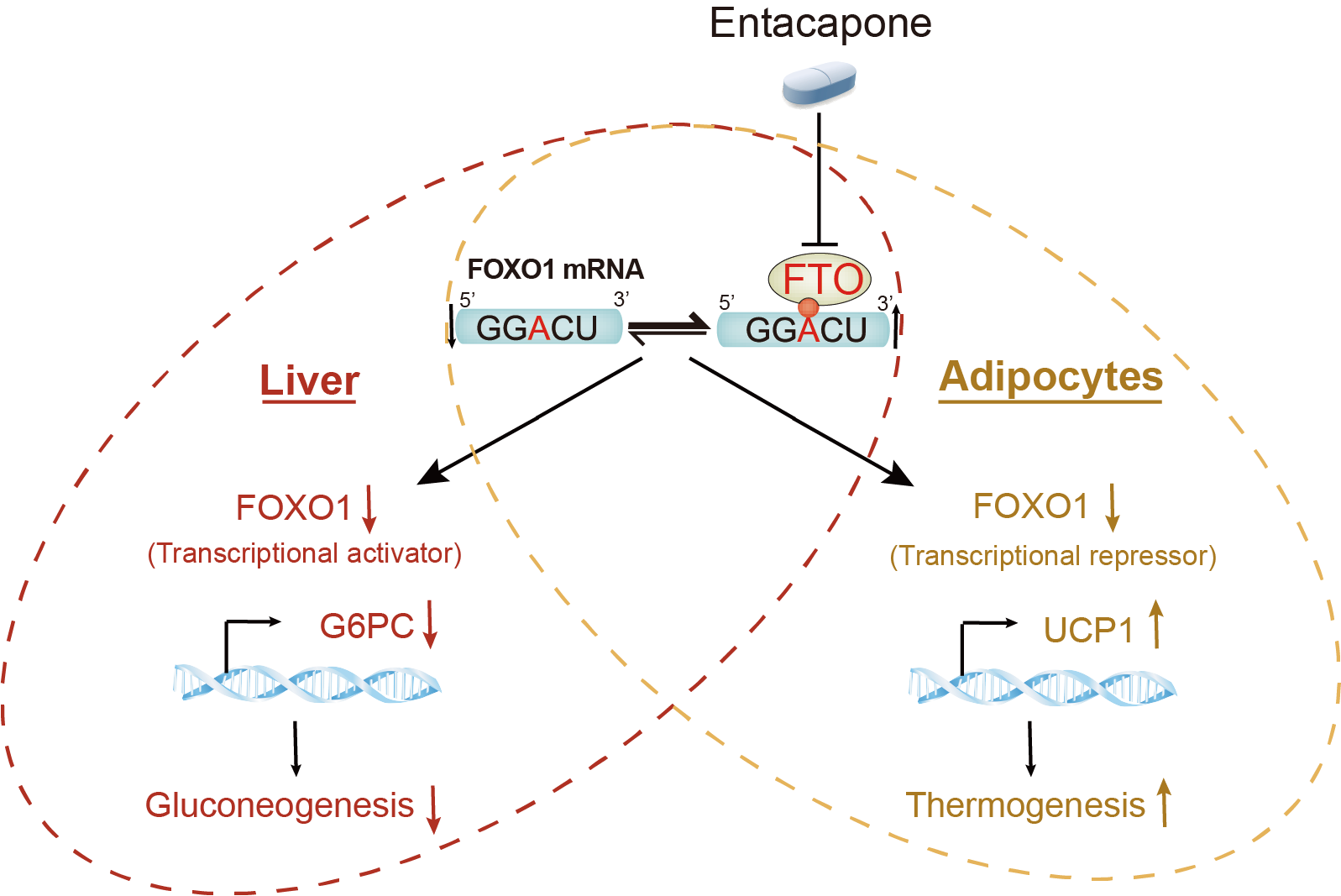
恩他卡朋通过抑制FTO影响FOXO1表达调控肝脏和脂肪中的糖脂代谢
论文链接


