 近日,中国科学院北京基因组研究所王前飞团队联合武汉大学黄赞团队,发现急性白血病表观靶向治疗新靶点,有望通过靶向酸性核磷蛋白ANP32A调节表观遗传修饰治疗肿瘤。相关成果以“ANP32A Regulates Histone H3 Acetylation and Promotes Leukemogenesis”为题在线发表于Leukemia杂志。
近日,中国科学院北京基因组研究所王前飞团队联合武汉大学黄赞团队,发现急性白血病表观靶向治疗新靶点,有望通过靶向酸性核磷蛋白ANP32A调节表观遗传修饰治疗肿瘤。相关成果以“ANP32A Regulates Histone H3 Acetylation and Promotes Leukemogenesis”为题在线发表于Leukemia杂志。
表观遗传变异在血液和实体肿瘤发生和发展中具有重要作用。研究发现肿瘤的表观遗传异常具有可逆性,可通过靶向表观调控因子如修饰酶等,进行有效调节。并且其靶点具有易靶向、可设计小分子药物等优势,是肿瘤靶向治疗可行的新策略。然而,现仅有极少数表观靶向药物在临床使用(如DNA甲基化转移酶抑制剂治疗骨髓增生异常综合征和组蛋白去乙酰化酶抑制剂治疗T细胞瘤疤瘤),远不能满足肿瘤临床治疗的需求。因此亟待找到其他参与肿瘤表观遗传程序的调控因子,为临床治疗提供潜在靶点和策略。
在该研究中,研究人员发现新调控因子ANP32A通过调节表观组蛋白H3乙酰化(acetyl-H3)修饰,促进白血病。在急性髓系白血病(acute myeloid leukemia,AML)病人细胞中,ANP32A异常高表达,对白血病细胞增殖、生存和克隆形成具有促进作用。研究人员通过转录组测序和免疫沉淀测序数据整合分析,以及功能实验验证发现,ANP32A缺失降低了acetyl-H3修饰水平,进而调控关键通路基因表达,促进AML。在ANP32A缺失的AML细胞中,acetyl-H3富集变化与基因表达变化显著正相关,其中包括脂代谢通路相关基因如APOC1。进一步功能实验证明,ANP32A缺失降低了acetyl-H3在基因APOC1启动子区的富集水平,下调APOC1基因的表达。更重要的是,在ANP32A缺失的AML细胞中,过表达APOC1能够恢复因ANP32A缺失引起的生长抑制。这些数据表明,ANP32A通过acetyl-H3调控关键通路,维持白血病细胞异常增殖和生存。
该研究首次揭示了ANP32A在白血病中作为致癌因子发挥功能;ANP32A蛋白只有249个氨基酸,结构适合利用小分子抑制剂或多肽有效干扰其功能,有望通过靶向ANP32A调节异常升高的acetyl-H3修饰,提高白血病疗效。
该研究得到国家自然科学基金资助。
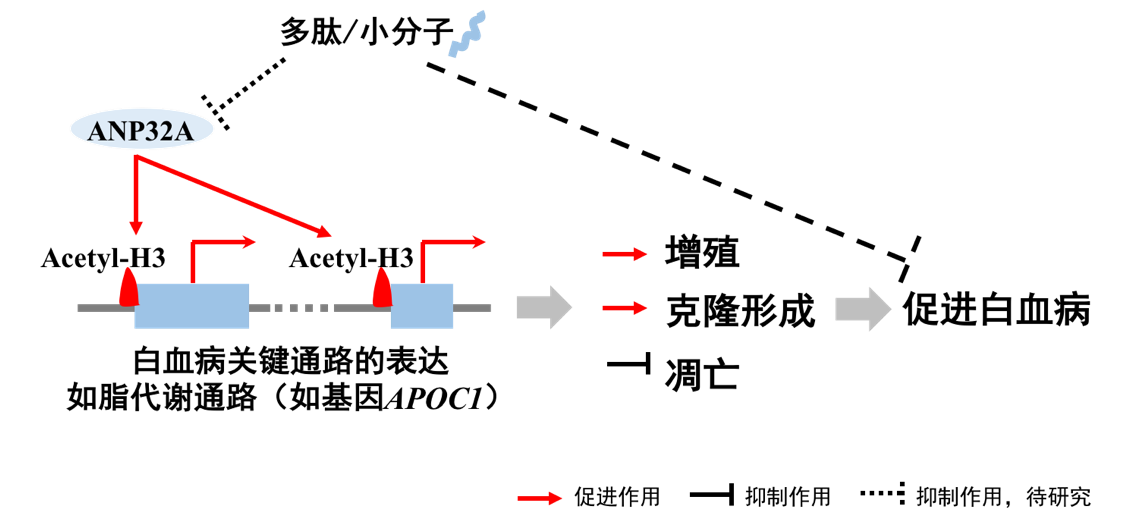
表观调控新因子ANP32A通过调节表观acetyl-H3促进白血病


