中国科学院北京基因组研究所杨运桂研究组与中国科学院动物研究所刘峰研究组合作研究,首次揭示m6A mRNA甲基化修饰在脊椎动物造血干细胞发育中的关键调控作用。该研究成果以“m6A modulates haematopoietic stem and progenitor cell specification”为题,于2017年9月6日在Nature杂志在线发表。
该合作研究团队在前期研究中发现了斑马鱼中的m6A甲基转移酶复合体(Ping et al, Cell Research 2014)。在此基础上,研究人员通过m6A测序技术(m6A-MeRIP-Seq)发现,缺失m6A甲基转移酶mettl3后,m6A在胚胎发育相关mRNA中的富集程度显著下降。同时,在斑马鱼的血液-血管系统中,可检测到mettl3的特异性表达。由此推测,m6A修饰与血液发育过程密切相关。系统的表型分析显示,在mettl3缺失的胚胎中,造血干细胞不能正常产生,血管的内皮特性却明显增强,内皮-造血转化过程受到阻断。m6A-MeRIP-Seq和RNA-Seq综合分析发现,在mettl3缺失的胚胎中,一系列动脉内皮发育相关的基因,尤其是notch1a的m6A修饰水平显著降低,而其mRNA水平却显著升高。上述结果证明,m6A修饰与EHT过程中内皮和造血基因表达的平衡调控相关。此外,YTHDF2-RIP-Seq和单碱基分辨率的m6A-miCLIP-Seq综合分析发现,m6A通过YTHDF2介导notch1a mRNA的稳定性,以维持EHT过程中内皮细胞和造血细胞基因表达的平衡,进而调控造血干细胞的命运决定。上述结果在小鼠中也得到了验证,证明m6A对造血干细胞命运决定的调控在脊椎动物中是保守的。
该工作首次揭示m6A mRNA甲基化修饰在脊椎动物造血干细胞命运决定中的调控机制,丰富了对m6A mRNA甲基化修饰在正常生理状态下的生物学功能的认识。上述成果不仅首次阐释RNA表观修饰在血液发育中的关键作用,还将为体外诱导扩增造血干细胞提供了理论指导。
中国科学院动物研究所刘峰研究员和中国科学院北京基因组研究所杨运桂研究员是该合作研究成果共同通讯作者。该研究得到了基金委、科技部和中科院战略先导等基金资助。
论文链接
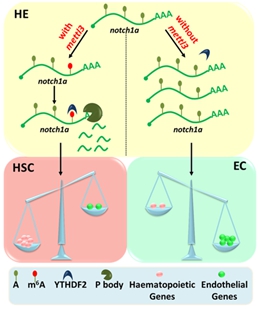
m6A修饰调控造血干细胞产生模式图。甲基转移酶Mettl3通过m6A修饰决定notch1a的mRNA水平,进而调控内皮-造血转化过程。
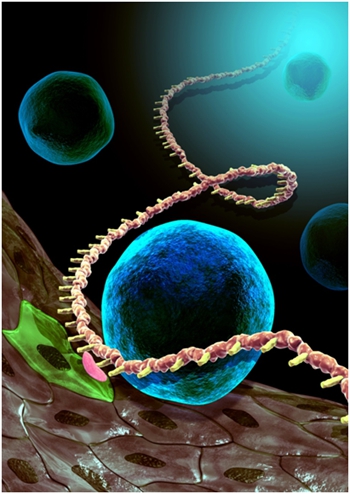
造血干细胞通过内皮-造血转换方式在主动脉血管底部产生。研究发现,新型的RNA甲基化修饰(红色)通过调控造血发育重要基因Notch mRNA的稳定性,从而决定内皮细胞(绿色)转变成造血干细胞(蓝色)。


