透明肾细胞癌(clear cell Renal Cell Carcinoma, ccRCC)是肾癌中最常见的亚型,90%以上的ccRCC患者中VHL抑癌基因是失活的,但在小鼠实验中却发现该基因的缺失并未能引起透明细胞癌形成,这意味着还存在其他的致瘤机制。近些年的研究发现,与肾癌发生发展、患者总体生存率以及预后相关的基因突变主要集中在表观调控因子上,这表明表观遗传变异对肾癌的发生发展起到了重要的作用。长期以来由于技术的限制,以前研究观察到的全基因组甲基化修饰包含了5-甲基胞嘧啶(5-mC)和5-羟甲基胞嘧啶(5-hmC)两部分修饰的总和,并不知道它们各自真实的修饰水平、相互调控关系及其生物学意义。
近日,中科院北京基因组研究所精准基因组医学重点实验室慈维敏课题组、基因组科学与信息重点实验室刘江课题组同北京大学第一医院周利群课题组合作,在单碱基水平探究了5mC和5hmC在ccRCC中的重编程模式和规律,发现了5hmC在肾癌发生中可能的驱动作用以及5hmC可作为肾癌潜在的预后标记物。该研究结果已在近期的Cell Research 杂志在线发表。
研究团队首先通过质谱、原发肿瘤组织芯片以及免疫组化染色分析发现了与以往研究不同的结果:同癌旁组织相比,肾癌样品中5mC的总体水平并没有显著变化,而5hmC在全基因组上的修饰则几乎在所有肿瘤患者中呈现一致的显著下调。进一步关联了5hmC和5mC的动态规律及临床信息后发现,5hmC水平可以作为独立因子预测患者的总体生存期:5hmC水平越低,患者的生存期越短。
研究团队还通过整合重亚硫酸盐测序(BS-Seq)和Tet氧化辅助的重亚硫酸盐测序(TAB-seq)分析,克服了以往大多数研究只关注启动子区域的甲基化状态,以及广泛使用的BS-Seq方法不能区分5mC和5hmC等局限,获得了单碱基分辨率的5mC和5hmC真实修饰水平的全基因组图谱,结果发现在肾癌发生过程中5hmC重编程被抑制,导致肾癌细胞中存在广泛的基因体区超甲基化。进一步研究还发现,基因体区的甲基化修饰同一些基因的沉默有显著关联。据推测,5mC或者5hmC在基因体区的改变可能是通过类似mRNA剪切的方式来调控基因表达的,但其具体功能还需深入研究。而在裸鼠模型实验中回调5hmC水平,发现可以减慢肿瘤细胞的侵袭性,抑制肿瘤生长。
该项研究不但清晰阐明了肾癌发生过程中5mC真实重编程规律,并阐明了5hmC重编程参与肾癌特异的DNA甲基化图谱形成。结合临床数据也提示,5hmC水平降低而非5mC水平降低是肾癌更敏感的预后表观标记物,而裸鼠实验中5hmC的回调抑制了肿瘤的生长也说明了5hmC在肾癌中的重编程不是一种伴随现象,更有可能是一种驱动力。该研究通过探索肾癌中5mC和5hmC重编程的动态变化规律,暗示5hmC可以作为肾癌预后监测的新型表观遗传标记物和靶向治疗的靶点。
该项研究得到重大基础研究项目和国家自然科学基金等项目的支持。
论文链接
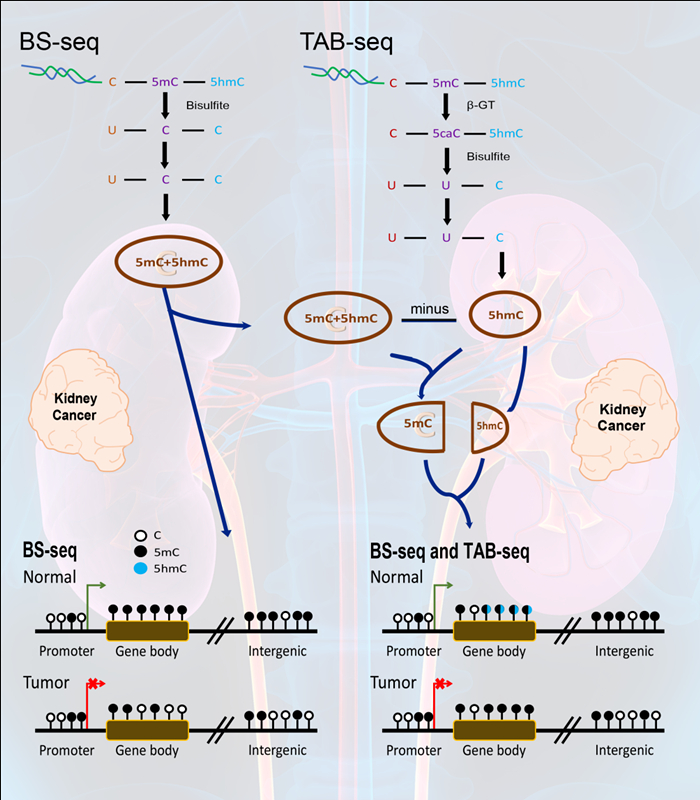
两种测序方案的区别与结合 左半部分:BS-seq结果包含5hmC和5mC;肾癌呈现整体低甲基化趋势。右半部分:TAB-seq确定5hmC;结合BS-seq,确定5mC;获得全基因组范围内单碱基精度的甲基化图谱;发现肾癌呈现整体高甲基化趋势;且主要体现在gene body区域。


