基因组DNA一直受到各种内源及外源损伤因素的影响,大多数的DNA损伤都能被多种DNA修复机制识别和修复。然而,总有一些DNA损伤逃脱修复机制的监控,阻碍S期DNA复制。为了避免受阻的复制叉被破坏进而产生DNA双链断裂,细胞进化出了跨损伤DNA合成(Translesion DNA synthesis, TLS)途径,利用特异的低保真度的DNA 聚合酶直接在损伤的对面合成DNA。
TLS分为无错旁路途径和易错旁路途径,前者在对应损伤的部位插入正确的核苷酸,而后者通常插入错误的核苷酸。在细胞中,易错损伤旁路途径是环境致癌物和其他DNA损伤试剂诱导基因组突变的主要机制,有效控制易错途径将有助于预防肿瘤发生。然而对于TLS聚合酶是如何招募到受阻部位完成其功能的具体分子机制目前仍不十分清楚。
近日,中科院北京基因组研究所重大疾病基因组与个体化医疗实验室郭彩霞课题组首次发现,错配修复关键蛋白MSH2能调控细胞内紫外辐射损伤引发的TLS过程。利用免疫共沉淀结合质谱技术,研究人员发现MSH2与TLS聚合酶Kappa (Polκ)结合,并且MSH2还调控TLS聚合酶与紫外引发的受阻复制叉的结合。
MSH2一方面通过影响泛素连接酶RAD18与染色质的结合来调控PCNA单泛素化水平进而影响TLS聚合酶招募, 另一方面MSH2也可在敲低Rad18的细胞中通过PCNA单泛素化不依赖的方式,上调TLS聚合酶在受阻复制叉处的富集。进一步研究发现,MSH2能够促进紫外辐射后细胞跨越基因组上光产物损伤的TLS过程,表明了MSH2在紫外光损伤处理后细胞应答方面具有新的作用。
此外,该课题组此前的研究发现MSH2还可调控氧化损伤后PCNA的单泛素化。这些研究成果有助于我们了解非传统错配修复导致基因组不稳定性的内在机制以及多种DNA损伤反应通路的相互作用,为预防癌症发生、增强肿瘤细胞对化疗试剂的敏感性和降低肿瘤耐药性突变的产生提供了重要的理论依据。
该项研究由中科院北京基因组研究所郭彩霞研究组和动物所生物膜与膜生物工程国家重点实验室唐铁山研究组合作完成,相关论文于9月13日在线发表于Nucleic Acids Research(doi:10.1093/nar/gkt793)。
该项工作得到了中国科学院、科技部、国家自然科学基金委的支持。
文章链接
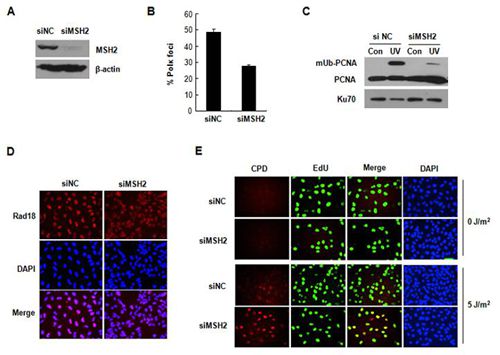
错配修复关键蛋白MSH2调控细胞内紫外辐射损伤引发的TLS过程


